近日,课题组2020级硕士生赖罗根同学以第一作者在国际权威-区Top期刊Chemica/Engineering Journal(IF=13.273)在线发表题为“Multifunctional MIL-101 nanoparticleswith Fenton-like reactions to Co-deliver LL-37 peptide and Vancomycin for targeted NIRimaging and Drug-resistant bacteria treatment”的研究论文,课题组郑鹏武教授、潘青山博士、朱五福教授为该论文的通讯作者。《Chemical Engineering Journa1》为中国科学院JCR分区中工程技术领域的TOP期刊、基础版和升级版均为1区,2021年最新影响因子(IF)为13.273 。
共享链接:https://authors.elsevier.com/a/1eZ6Q4x7R2cUkF

细菌感染已成为全球最大的公共卫生问题之一,严重威胁着数百万人的生命。据世界卫生组织(WHO)报告,每年约有70万人死于耐药性细菌感染,预计到2050年每年将有1000万人死于耐药性细菌感染。目前抗细菌感染性疾病的传统方法仍以抗生素治疗为主。然而,在过去的几十年里,抗生素药物的发展停滞不前,而抗生素耐药性却不断上升。单一抗菌药物的过度使用被视为抗生素耐药性发展的主要罪魁祸首。因此,迫切需要开发一种用于治疗由细菌引起的感染的新疗法。在研发新型抗菌药物的同时,对细菌感染进行早期诊断,监测抗菌治疗效果尤为重要。在多种诊断技术中,荧光成像具有灵敏度高、成本低、安全可靠等优点,是一种良好的诊断方法。目前荧光基团标记的多肽已成功应用于癌症诊断成像和治疗,但关注细菌感染荧光影像诊断的研究较少,加之细菌感染异质性高、适应性强,误诊和诊断太晚的情况不断增加。因此,迫切需要开发可视化诊疗平台,以实现细菌感染的准确成像、成功根除细菌和实时监测治疗进展。
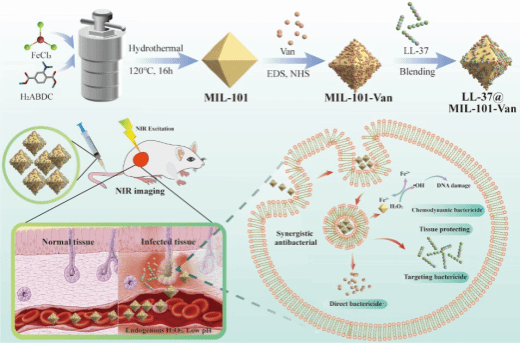
在这项工作中,作者报道了一种新型NIR成像和协同抗菌多功能纳米系统(LL-37@MIL101-Van),可用于体内实时成像和耐药细菌靶向治疗。多功能纳米系统以具有类Fenton催化的MIL-101为核心,该纳米核心与万古霉素共价连接,并在表面用抗菌肽LL-37进行修饰。在内源性H20,过表达和弱酸性细菌感染的环境下,LL-37@MIL-101-Van优异的类芬顿反应活性可以有效催化分解产生羟基自由基(·OH),从而触发高效的化学动力学疗法(CDT)且具有组织保护的作用。通过CDT与抗菌肽和抗生素治疗相结合,在体外和体内成功实现对MRSA的特异性靶向成像、协同抗菌治疗等效果。此外,高毒性的·OH和抗菌肽LL-37发挥协同抗菌作用,减少抗生素的使用,最大限度地减少抗生素耐药性的发展。体内MRSA感染模型证明了该抗菌纳米系统具有监测细菌感染治疗进展和有效促进细菌感染伤口愈合的能力。
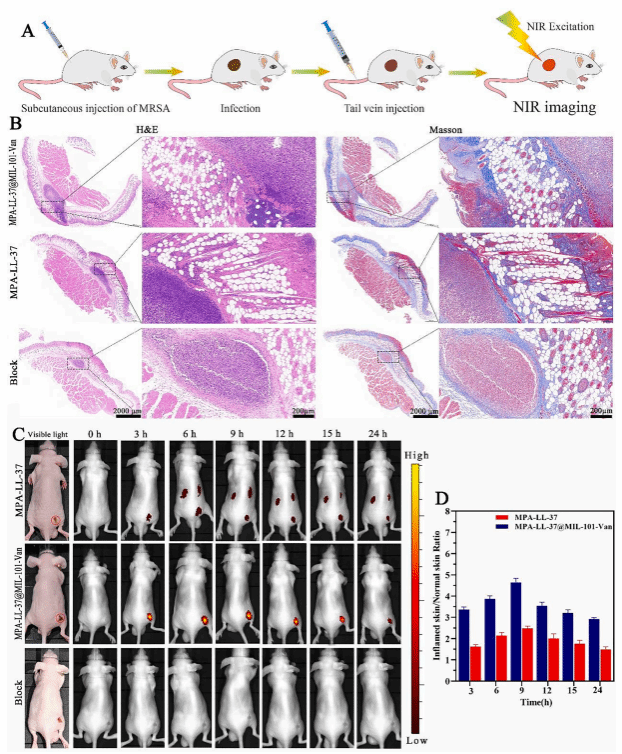
鉴于此,本研究提出了一种新型、高效、多功能的NIR成像和治疗系统,该研究提供了一种多功能协同纳米抗菌策略,该策略整合了CDT、抗菌肽和抗生素,用于高效、靶向的抗菌治疗,并具有实时伤口监测能力。该研究可为评估伤口愈合、协同抗菌治疗和降低抗生素耐药性开辟一条新思路。

该研究亮点:制备了具有类芬顿反应的多功能治疗性纳米复合平台;该平台可用于耐药细菌感染治疗和近红外成像;该诊疗策略结合CDT和抗菌肽,用于靶向抗菌治疗和实时伤口监测成像。
 最新更新
最新更新